Pourquoi le savon est-il nécessaire pour former des bulles?
Première observation:
Quand nous mélangeons de l’eau et du sucre, nous observons qu’il est impossible de former des bulles, le résultat est le même lorsque nous mélangeons de l’eau et de la glycérine.
Conclusion:
Grâce à cette petite expérience, nous avons pu remarquer que le liquide vaisselle est indispensable.
Deuxième observation:
Lorsqu’il y a uniquement du liquide vaisselle, nous pouvons former des bulles, mais elles sont relativement petites t elles durent peu de temps. Cependant lorsque celui-ci est associé à l’eau, des bulles se forment et leur taille est moyenne, mais leur durée de vie est assez limitée. Conclusion: l’eau et le savon sont deux ingrédients indispensables à la formation de bulles de savon. Nous pouvons donc penser que le sucre et la glycérine jouent un rôle superficiel.
Ces deux expériences, nous poussent donc chercher la composition du savon. Ce dernier est constitué d’ions carboxylates qui sont des molécules bien particulières: les tensioactifs qui possèdent deux parties bien distinctes: une tête hydrophile qui a tendance à se mélanger à l’eau et qui est chargé négativement, et une queue hydrophobe (lipophile) qui contrairement à la tête, cette partie va plutôt avoir tendance à émerger de l’eau, puisque celle ci la repousse. De cette particularité, il en résulte que ces molécules de savon vont venir se placer en surface la partie hydrophile dans l’eau et la partie hydrophobe à l’extérieur, ces molécules sont qualifiées de molécules amphiphiles mais elles sont aussi dites surfactantes car elles concernent surtout la surface du liquide.
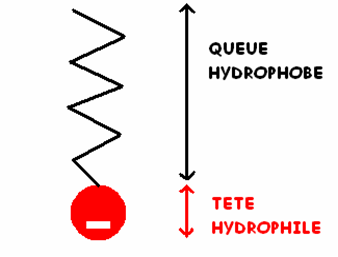
Schéma d’une molécule de savon (ion carboxylate)
Grâce à ce mécanisme et à cette simple définition: « une bulle de savon est un volume d’air entouré d’une fine membrane constituée de mélanges savonneux », nous pouvons en déduire la disposition des ions carboxylates (molécules de savon) dans une bulles ou un film savonneux.
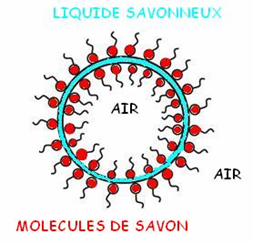
Schéma représentant la disposition des molécules de savon dans un film savonneux.
Les molécules de savons sont à peu près 1000 fois plus petites que l’épaisseur de la paroi de la bulle (des nanomètres par rapport à quelques microns).
Nous observons que dans un film savonneux, il y a de part et d’autre du film d’eau des molécules de savon, cela se fait grâce aux tensioactifs et permet de stabiliser la bulle de savon.
Les tensioactifs ont une autre particularité qui est de diminuer la tension superficielle, en effet contenue dans un liquide ici le produit à bulles, ces molécules ont besoin d’énergie pour venir se placer à la surface du liquide, c’est pourquoi plus la surface est petite, moins de molécules en surface sont nécessaires et ainsi le système est favorisé. Lorsque nous formons une bulle le système est défavorisé car nous avons besoin d’un nombre plus important de molécules en surface ce qui coûte de l’énergie, car nous devons étirer la surface. Nous avons donc dans ce liquide une surface élastique qui veut être minimale ceci est la tension de surface.